Оксид азота (IV) (диоксид азота) – неорганическое вещество, имеет химическую формулу NO2.
Краткая характеристика оксида азота (IV)
Физические свойства оксида азота (IV)
Получение оксида азота (IV)
Химические свойства оксида азота (IV)
Химические реакции оксида азота (IV)
Применение и использование оксида азота (IV)
- Краткая характеристика оксида азота (IV):
- Физические свойства оксида азота (IV):
- Применение и использование оксида азота (IV):
- Оксиды азота. Азотная кислота
- Азотная кислота
- Химические свойства
- Получение
- Применение
- Оксид азота (II)
- Физические свойства
- Промышленный метод
- Лабораторные методы
- Химические свойства
- Роль в живых организмах
- Защитная функция монооксида азота
- Медицинские препараты, влияющие на сигналювання NO
- Токсичность
- азота (IV) оксид
- Симптомы хронического отравления:
- Дополнительная информация:
- Окислы азота
- Закись азота для чего
- Азот оксид
- Двуокись азота
- Азотистый ангидрид N2O3
- Оксиды азота
- Способы получения
- NO — оксид азота (II), монооксид азота
- I. NO — окислитель
- II. NO — восстановитель
- NO2 — оксид азота (IV), диоксид азота
- NO2 — кислотный оксид, смешанный ангидрид 2-х кислот
- NO2 — очень сильный окислитель
- N2O3 и N2O5 — неустойчивые вещества
- 📽️ Видео
Краткая характеристика оксида азота (IV):
Оксид азота (IV) – неорганическое вещество, ядовитый газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.
Оксид азота (IV) содержит один атом азота и два атома кислорода.
Химическая формула оксида азота (IV) NO2.
В обычном состоянии NO2 существует в равновесии со своим димером N2O4. Склонность к его образованию объясняется наличием в молекуле NO2 неспаренного электрона.
При температуре 140 °C оксид азота (IV) состоит только из молекул NO2, но очень тёмного, почти чёрного цвета.
В точке кипения NO2 – +21,1 °C представляет собой желтоватую жидкость, содержащую около 0,1 % NO2.
При температуре ниже +21°С – это бесцветная жидкость (или желтоватая из-за примеси мономера).
При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4.
Кислотный оксид.
Оксид азота (IV) высокотоксичен. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.
Физические свойства оксида азота (IV):
| Наименование параметра: | Значение: |
| Химическая формула | NO2 |
| Синонимы и названия иностранном языке | nitrogen dioxide (англ.)nitrogen(IV) oxide (англ.)азота двуокись (рус.)азота диоксид (рус.)диазота тетраоксид (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | красно-бурый газ или желтоватая жидкость |
| Цвет | красно-бурый, желтоватый |
| Вкус | —* |
| Запах | характерный острый запах |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Плотность (состояние вещества – жидкость, при 0 °C), кг/м3 | 1491 |
| Плотность (состояние вещества – жидкость, при 0 °C), г/см3 | 1,491 |
| Плотность (состояние вещества – газ), кг/м3 | 2,0527 |
| Плотность (состояние вещества – газ), г/л | 2,0527 |
| Температура кипения, °C | 21,1 |
| Температура плавления, °C | -11,2 |
| Молярная масса, г/моль | 46,0055 |
Примечание:
* — нет данных.
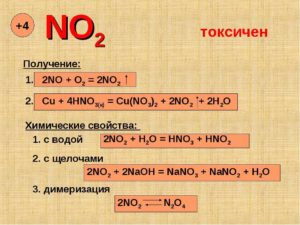
Оксид азота (IV) в лаборатории получают в результате следующих химических реакций:
- 1. путем воздействия концентрированной азотной кислоты на медь:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O.
- 2. путем термического разложения нитрата свинца:
2Pb(NO3)2 → 2PbO + 4NO2 + O2 (t = 200-470 °C).
Оксид азота (IV) относится к кислотным оксидам.
Химические свойства оксида азота (IV) аналогичны свойствам кислотным оксидов других неметаллов. Однако отличается высокой химической активностью. Реагирует с неметаллами. Сильный окислитель. Поэтому для него характерны следующие химические реакции:
1. реакция оксида азота (IV) и углерода:
2NO2 + 2С → 2СO2 + N2.
В результате реакции образуются углекислый газ и азот. Углерод сгорает в оксиде азота (IV).
2. реакция оксида азота (IV) и фосфора:
10NO2 + 8P → 4P2O5 + 5N2.
В результате реакции образуются оксид фосфора (V) и азот. Фосфор сгорает в оксиде азота (IV).
3. реакция оксида азота (IV) и серы:
2S + 2NO2 → 2SO2 + N2.
В результате реакции образуются оксид серы (IV) и азот. Сера сгорает в оксиде азота (IV).
4. реакция оксида азота (IV) и фтора:
2NO2 + 2F2 → 2NO2F.
В результате реакции образуeтся фторид-диоксид азота (V).
5. реакция оксида азота (IV) и калия:
NO2 + K → KNO2.
В результате реакции образуется соль – нитрит калия.
6. реакция оксида азота (IV) и меди:
2NO2 + 4Cu → 4CuO + N2 (t = 500-600 °C).
В результате реакции образуются оксид меди и азот.
7. реакция оксида азота (IV) и висмута:
6NO2 + Bi → Bi(NO3)3 + 3NO (t = 70-110 °C).
В результате реакции образуются оксид висмута и оксида азота (II).
8. реакция оксида азота (IV) и цинка:
4NO2 + Zn → 2NO + Zn(NO3)2 (t = 500-600 °C).
В результате реакции образуются оксид азота (II) и нитрат цинка. При этом для проведения реакции используется жидкий оксид азота (IV) и цинк в виде порошка.
9. реакция оксида азота (IV) и натрия:
2NO2 + Na → NO + NaNO3.
В результате реакции образуются соль – нитрат натрия и оксид азота (II). При этом для проведения реакции используется жидкий оксид азота (IV).
10. реакция оксида азота (IV) и водорода:
2NO2 + 7H2 → 4H2O + 2NH3 (kat = Pt, Ni).
В результате реакции образуются аммиак и вода.
11. реакция оксида азота (IV) и озона:
2NO2 + O3 → N2O5 + O2 (t = -78 оС).
В результате реакции образуются оксид азота (V) и кислород.
12. реакция оксида азота (IV) с бромистым водородом (бромоводородом):
NO2 + 2HBr → NO + Br + H2O (tо).
В результате химической реакции получается оксид азота (II), бром и вода.
13. реакция оксида азота (IV) с йодоводородом:
2HI + NO2 → I2 + NO + H2O.
В результате химической реакции получается оксид азота (II), йод и вода.
14. реакция оксида азота (IV) и воды:
2NO2 + H2O → HNO3 + HNO2,
3NO2 + H2O → 2HNO3 + NO (tо).
В результате химической реакции в первом случае получается азотная кислота и азотистая кислота, во втором случае – поскольку азотистая кислота неустойчива, при растворении NO2 в тёплой воде образуются азотная кислота и оксид азота (II).
15. реакция оксида азота (IV), кислорода и воды:
4NO2 + 2H2O + O2 → 4HNO3.
В результате химической реакции получается азотная кислота.
16. реакция оксида азота (IV) и оксида калия:
K2O + 2NO2 → KNO2 + KNO3 (t = 150-200 оС).
В результате химической реакции получается нитрат калия и нитрит калия.
17. реакция оксида азота (IV) и гидроксида калия:
2NO2 + 2KOH → KNO3 + KNO2 + H2O.
В результате химической реакции получается нитрат калия, нитрит калия и вода.
18. реакция оксида азота (IV) и гидроксида натрия:
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O.
В результате химической реакции получается нитрат натрия, нитрит натрия и вода. Гидроксид натрия – разбавленный раствор.
19. реакция оксида азота (IV) и хлорида калия:
2NO2 + KCl → NOCl + KNO3.
В результате химической реакции получается хлорид нитрозила и нитрат калия. При этом для проведения реакции используется жидкий оксид азота (IV).
20. реакция оксида азота (IV) и бромида калия:
2NO2 + KBr → NOBr + KNO3.
В результате химической реакции получается бромид нитрозила и нитрат калия. При этом для проведения реакции используется жидкий оксид азота (IV).
21. реакция оксида азота (IV) и фосфористой кислоты:
H3PO3 + NO2 → H3PO4 + NO (t = 30-50 оС).
В результате химической реакции получается ортофосфорная кислота и оксид азота (II).
22. реакция термического разложения оксида азота (IV):
2NO2 → 2NO + O2 (t = 500 оС).
В результате химической реакции получается кислород и оксид азота (II).
Применение и использование оксида азота (IV):
Оксид азота (IV) используется при производстве серной и азотной кислот, а также в качестве окислителя в жидком ракетном топливе.
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
оксид азота (IV) реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида азота (IV)
реакции с оксидом азота (IV)
Видео:RM 'No.2 (with 박지윤)' VisualizerСкачать

Оксиды азота. Азотная кислота
Известны несколько оксидов азота.
Несолеобразующие оксиды: N2O, NO
Солеобразующие оксиды: N2O3, NO2, N2O4, N2O5
Все оксиды азота, кроме N2O, ядовитые вещества.
Оксид азота (I) N2O – это бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворимый в воде, но не взаимодействует с ней. При достаточно высокой температуре разлагается по уравнению:
2N2O = 2N2 + O2
В смеси с кислородом N2O используется в медицине для наркоза («веселящий» газ).
Наиболее важными являются оксиды азота (II) и (IV).
Оксид азота (II) NO – бесцветный газ, не имеет запаха. В воде малорастворим, относится, как и N2O, к несолеобразующим оксидам. Оксид азота (II) NO образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре:
N2 + O2 = 2NO
В лаборатории оксид азота (II) получают, например, при взаимодействии меди и разбавленной азотной кислоты:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
Оксид азота (II) в промышленности получают каталитическим окислением аммиака и используют для получения азотной кислоты:
4NH3 + 5O2 = 4NO + 6H2O
Оксид азота (II) на воздухе легко окисляется до оксида азота (IV):
2NO + O2 = 2NO2
Оксид азота (IV)
Оксид азота (IV) NO2 – ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде. Оксид азота (IV) является смешанным оксидом, которому соответствуют две кислоты: азотистая HNO2 и азотная HNO3. Поэтому взаимодействие с водой происходит по уравнению:
2NO2 + H2O = HNO2 + HNO3
При взаимодействии NO2 с водой в присутствии кислорода (на воздухе) образуется только азотная кислота:
4NO2 + O2 + 2H2O ⇄ 4HNO3
При растворении NO2 в щелочи, например NaOH, образуются две соли (нитрат и нитрит) и вода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
В избытке кислорода образуется только нитрат натрия:
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Ниже 22 0С молекулы оксида азота (IV) NO2 легко соединяются попарно и образуют бесцветную жидкость состава N2O4, которая при охлаждении до – 10,2 0С превращается в бесцветные кристаллы.
https://www.youtube.com/watch?v=D3V_jX6GFMw
В лаборатории NO2 можно получить при взаимодействии, например, меди с концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
В промышленности NO2 получают путем окисления NO кислородом и далее используют для получения азотной кислоты.
Оксид азота (III) N2O3 – это темно-синяя жидкость, является кислотным оксидом. При взаимодействии с водой образуется азотистая кислота:
Оксид азота (III)
N2O3 + H2O = 2HNO2
Оксид азота (V) N2O5 – бесцветные кристаллы, хорошо растворимые в воде с образованием азотной кислоты:
N2O5 + H2O = 2HNO3
Азотная кислота
Физические свойства
Азотная кислота HNO3 – бесцветная жидкость, имеет резкий запах, легко испаряется, кипит при температуре 83 0С. При попадании на кожу азотная кислота может вызвать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой). С водой азотная кислота смешивается в любых соотношениях.
Обычно применяемая в лаборатории концентрированная азотная кислота содержит 63% HNO3. При хранении довольно легко, особенно на свету разлагается по уравнению:
4HNO3 ⇄ 2H2O + 4NO2↑ + O2↑
Выделяющийся газ NO2 окрашивает азотную кислоту в бурый цвет.
Химические свойства
Азотная кислота
Кислотно – основные свойства
Азотная кислота – одна из наиболее сильных кислот. В водных растворах она полностью диссоциирована на ионы:
HNO3 ⇄ H+ + NO3—
Как и все кислоты, она реагирует:
а) с оксидами металлов:
MgO + 2HNO3 = Mg(NO3)2 + H2O
б) с основаниями:
Mg(OH)2 + HNO3 = Mg(NO3)2 + H2O
в) с солями более слабых кислот:
K2CO3 + HNO3 = KNO3 + CO2↑ + H2O
Окислительно – восстановительные свойства
Азотная кислота является одним из сильнейших окислителей. Ее окислительно-восстановительные свойства обусловлены присутствием в молекуле HNO3 атома азота в высшей степени окисления N+5 в составе кислотного остатка NO3—.
Окислительные свойства кислотного остатка NO3— значительно сильнее, чем ионов водорода Н+, поэтому азотная кислота взаимодействует практически со всеми металлами, кроме золота и платины, находящимися в конце ряда напряжений.
Так как окислителем в HNO3 являются ионы NO3—, а не ионы Н+, то при взаимодействии HNO3 с металлами практически никогда не выделяется водород.
Нитрат-ионы NO3— при взаимодействии HNO3 с металлами восстанавливаются тем полнее, чем более разбавлена кислота и чем более активен металл. На следующей схеме показано, какие продукты могут образоваться при восстановлении HNO3:
Общая схема взаимодействия азотной кислоты с металлами
Концентрированная HNO3 при взаимодействии с наиболее активными металлами (до Al в ряду напряжений) восстанавливается до N2O. Например:
10HNO3 + 4Ca = 4Ca(NO3)2 + N2O↑ + 5H2O
Концентрированная HNO3 при взаимодействии с менее активными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2. Например:
4HNO3 + Ni = Ni(NO3)2 + 2NO2↑ + 2H2O
Аналогично концентрированная азотная кислота реагирует с некоторыми неметаллами. Неметалл при этом окисляется до оксокислоты. Например:
5HNO3 + P = HPO3 + 5NO2↑ + 2H2O
Следует отметить, что концентрированная HNO3 пассивирует такие металлы, как Fe, Al, Cr. Сущность пассивирования заключается в образовании на поверхности металла тонкой, но очень плотной оксидной плёнки, предохраняющей металл от дальнейшего взаимодействия с кислотой; например:
3Al + 12HNO3 = Al(NO3)3 + Al2O3 + 9NO2↑ + 6H2O
Разбавленная HNO3 реагирует с наиболее активными металлами (до Al) с образованием аммиака или нитрата аммония NH4NO3:
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
При взаимодействии разбавленной азотной кислоты с менее активными металлами образуется оксид азота (II) NO:
8HNO3 + 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O
Таким же образом разбавленная HNO3 взаимодействует с некоторыми неметаллами:
2HNO3 + S = H2SO4 + 2NO↑
Взаимодействие азотной кислоты с медью
Получение
В лаборатории азотную кислоту получают при взаимодействии безводных нитратов с концентрированной серной кислотой:
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
В промышленности получение азотной кислоты идет в три стадии:
- Окисление аммиака до оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O
- Окисление оксида азота (II) в оксид азота (IV):
2NO + O2 = 2NO2
- Растворение оксида азота (IV) в воде и избытком кислорода:
4NO2 + 2H2O + O2 = 4HNO3
Применение
Азотную кислоту применяют для получения азотных удобрений, лекарственных и взрывчатых веществ.
Соли азотной кислоты
Соли азотной кислоты называются нитратами. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры применяют как минеральные азотные удобрения, так как азот является одним из основных элементов питания растений.
Все соли азотной кислоты хорошо растворимы в воде.
Соли азотной кислоты, как и она сама, являются сильными окислителями.
https://www.youtube.com/watch?v=OScudcXNK5A
При нагревании все нитраты разлагаются с выделением кислорода, характер других продуктов разложения зависит от положения металла в ряду напряжений:
Примеры:
2NaNO3 = 2NaNO2 + O2↑
2Zn(NO3)2 = 2ZnO + 4NO2↑ + O2↑
2AgNO3 = 2Ag + 2NO2↑ + O2↑
*на изображении записи кристаллы нитрата меди (II)
Видео:Liszt Hungarian Rhapsody No.2 • Volker Hartung • Cologne New Philharmonic OrchestraСкачать

Оксид азота (II)
Оксид азота (II), оксид (II) оксид, окись азота — неорганическое соединение состава NO. При обычных условиях является бесцветным, токсичным и негорючей газом. В жидком и твердом состояниях соединение димеризуеться с образованием оксида N 2 O 2.
Монооксид азота относится к несолетвирних оксидов: с водой он не образует кислоту или основание, а непосредственно реагируя с основами и с кислотами, не образует солей.
Физические свойства
Оксид азота NO при обычных условиях является бесцветным газом с очень низкой температурой кипения (-151,8 ° С) и температурой плавления (-163,6 ° С). В твердом состоянии, благодаря наличию неспаренного электрона, соединение полностью димеризуеться с образованием оксида N 2 O 2, а в жидком — примерно на четверть.
В воде растворяется трудно: при обычной температуре лишь около 5 см³ в 100 г воды.
Промышленный метод
В промышленных масштабах синтез оксида азота (II) является одной из стадий в получении азотной кислоты. Его получают окислением аммиака кислородом воздуха в присутствии катализаторов:
Количество преобразованного в NO аммиака составляет примерно 93-98%. Другими, побочными, реакциями является образование азота и оксида азота (I):
Кроме этого, может происходить частичное разложение конечного продукта, NO, а также его взаимодействие с аммиаком:
Согласно одной из самых распространенных теорий механизма окисления, предложенной Максом Боденштейном, аммиак окисляется атомарным кислородом, адсорбированным на катализаторе с образованием гидроксиламина, который постепенно разлагается с образованием NO:
Основными применяемыми катализаторами являются платина и, в меньшей степени, родий и палладий. Несмотря на их высокую стоимость, они имеют преимущество в высшем выходе реакции и меньшей склонности к отравлению.
Лабораторные методы
В лабораториях монооксид азота обычно добывают взаимодействием разбавленной азотной кислоты с медью при некотором нагревании по реакции:
Применяются также реакции восстановления нитритов в разведенной серной кислоте:
Полученный такими методами NO может быть загрязнен примесями (прежде всего, N 2 O), поэтому он требует дополнительной очистки.
Химические свойства
Наиболее характерной свойством монооксида азота является его способность легко сочетаться при обычных условиях с кислородом воздуха с образованием диоксида азота (реакция имеет большое значение при производстве азотной кислоты):
При высокотемпературном нагреве и в присутствии катализатора BaO, газообразные NO разлагается на простые соединения. Жидкий NO с течением времени может диспропорционуваты с образованием оксидов азота (I) и азота (III):
При взаимодействии с галогенами или серной кислотой (в присутствии кислорода), NO окисляется с образованием соединений нитрозила:
Аналогично он образует нитрозильни комплексы с металлами в водных растворах солей:
Оксид азота восстанавливается до свободного азота графитом, красным фосфором, неметаллическими соединениями-восстановителями, а также некоторыми металлами:
Роль в живых организмах
Роль оксида азота (II) как сигнальной молекулы в живых организмах была открыта в 1980-х годах, а в 1998 Роберт Ферчготт, Луис Игнарро и Ферид Мурад получили Нобелевскую премию по физиологии или медицине за выяснение его функций в сердечно-сосудистой системе.
Монооксид азота является паракринным фактором благодаря своей способности быстро диффундировать через мембраны клеток, однако из-за высокой реакционность расстояние такой диффузии ограничена 1 мм а время полжизни молекул NO составляет 5-10 секунд.
Азот мооноксид выполняет сигнальную функцию как у животных, так и у растений, даже некоторые бактерии могут чувствовать очень небольшие его концентрации и двигаться в сторону от источника этого соединения.
https://www.youtube.com/watch?v=85wd0n9g2HY
У млекопитающих NO задействован в ряде физиологических процессов, таких как регуляция артериального давления, передача нервных импульсов, свертывания крови и иммунный ответ.
Синтез оксида азота (II) осуществляется путем деаминирование аминокислоты аргинина и обеспечивается ферментом NO-синтазы (NOS), что у млекопитающих трех изоформы: нейрональная (nNOS), индуцибельной (iNOS) и эндотелиальной (eNOS). nNOS и eNOS экспрессируются в соответствующих типах клеток конститутивно и резко увеличивают свою активность в ответ на рост концентрации Ca 2+.
Зато активация iNOS осуществляется на уровне транскрипции под влиянием эндотоксинов или цитокинов воспаления, в частности в таких клетках как макрофаги и нейтрофилы, и не зависит от цитоплазматического уровня кальция.
Одной из мишеней монооксида азота в клетках млекопитающих, в том числе и гладких мышцах, является фермент гуанилатциклазы, в активном центре которого он присоединяется к атому железа и таким образом увеличивает энзиматическую активность. Циклический ГМФ, что является продуктом гуанилатциклазы, является вторичным посредником и запускает в клетке каскад реакций, обеспечивающих физиологическую ответ, в случае гладких мышц — их расслабление.
NO может действовать также и цГМФ-независимым путем, например изменять активность белков путем ковалентной нитрозилювання тиольных групп (-SH) специфических остатков цистеина в их составе.
Защитная функция монооксида азота
У растений NO участвует в защитных реакциях во время повреждений и инфекций. Также монооксид азота играет роль в функционировании иммунной системы животных.
Активированные макрофаги и нейрофилов (а также клетки эндотелия) производят его в больших количествах во время воспалительных процессов.
Вместе с NO они выделяют супероксид-он (O-2), эти два соединения соединяясь образуют очень токсичен пероксинитрит (OONO -) нужен для того, чтобы убить поглощены бактерии.
Медицинские препараты, влияющие на сигналювання NO
Из препаратов, влияющих на сигнальный путь монооксида азота, первым начал использоваться еще в XIX веке нитроглицерин для борьбы со стенокардией. Это соединение медленно расщепляется в организме и действует как источник NO длительное время.
NO в свою очередь обеспечивает расширение сосудов и уменьшения нагрузки на сердце. Такое действие нитроглицерина была открыта благодаря наблюдению, что больные стенокардией работники фабрик, на которых изготавливали это соединение, сильнее страдали от боли на выходных.
Врачи настолько часто слышали такие сообщения пациентов, обратили внимание на терапевтический эффект нитроглицерина. С тех пор было разработано много других нитровазодиляторив.
Сам NO не имеет терапевтического действия при стенокрадии, через очень небольшое время полжизни, однако его иногда используют в вдыхаемой форме для облегчения легочной гипертензии.
Существуют также препараты, имеющие другие мишени в сигнальном пути NO. Например, силденафил подавляет деятельность фосфодиэстеразы, которая расщепляет цГМФ, таким образом продолжая продолжительность действия сигнала.
Это соединение была впервые предложена для лечения стенокрадии, однако выяснилось, что она наиболее эффективно влияет на изоформу цГМФ-фосфодиэстеразы, експресуетсья в сосудах пениса, и вызывает их расширение и, соответственно, эрекцию.
Поэтому силденафил (под названием Виагра) стал использоваться для лечения эректильной дисфункции.
Токсичность
Оксид NO раздражает дыхательные пути и глаза. Симптомы отравления зьявляють только через определенный период задержки в несколько часов. Ими являются: раздражение горла, затрудненное дыхание, головная боль, тошнота. Дальнейшие осложнения при отсутствии лечебных мероприятий могут вызывать полную потерю сил, непостоянство дыхания, цианоз, а также смерть в результате отека легких.
Пораженного NO необходимо убрать из опасной территории, провентилировать легкие кислородом. Дальнейшие 72 часа необходимо обеспечить надзор и исключить любую физическую деятельность, поскольку это может привести к развитию отека легких. При попадании вещества в ое или на кожу, необходимо тщательно промыть пораженное место теплой водой и обратиться к врачу.
https://www.youtube.com/watch?v=yHMrqlsaaPw
Мерами безопасности при работе с оксидом азота (I) является наличие защитных резиновых (тефлоновых) перчаток, герметичных очков, респиратора.
Видео:Dmitri Shostakovich - Waltz No. 2Скачать

азота (IV) оксид
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
азота двуокись
азота диоксид
красно-бур. газ В жидком виде существует в виде димерной желтой жидкости. В твердом виде — бесцветен.
вода: реагирует
сероуглерод: растворим
хлороформ: растворим
1,491 (0°C, г/см3)
N2O4 + 2H+ + 2e- → 2HNO2, E = 1,07 В (вода, 20 C)
Общий характер действия. Сравнительная токсичность NO и NO2 зависит от их концентрации и длительности воздействия. При 1-5 мг/л NO токсичнее NO2. При 0,2-0,7 мг/л, но длительном воздействии (6-8 ч), наоборот, NO2 токсичнее окиси азота (Грохольская).
NO2 обладает выраженным раздражающим и прижигающим действием на дыхательные пути, особенно глубокие, что приводит к развитию токсического отека легких; угнетает аэробное и стимулирует анаэробное окисление в легочной ткани.
Не исключена возможность общего действия, в том числе за счет всасывающихся в кровь с поверхности легких продуктов клеточного распада.
Животные. Для белых мышей при 2-часовой ингаляции JIK50 = 0,9 мг/л. При 0,0095-0,019 мг/л (1 ч) снижается содержание в крови эритроцитов и гемоглобина, увеличивается уровень билирубина и метгемоглобина (0,0019 мг/л не влияет иа эти показатели); при 0,006 мг/л (2 ч) резко повышается смертность после заражения пневмококковой инфекцией (Васильев и др.
; Clark, Tabershaw; Dillmann et al.; Treshow, Lytle). Для белых крыс JIK50 = 0,22 мг/л (1 ч), 0,31 мг/л (30 мин), 0,79 мг/л (5 мин). На вскрытии — отек и гнойные очаги в легких.
Вдыхание 0,004-0,013 мг/л в течение 17 ч снижает способность легочной ткани противостоять инфекции, а 0,038 мг/л (в течение 72 ч) и 0,032 мг/л (в течение 2-24 ч) вызывают гипертрофию мерцательного эпителия бронхиолей и утрату ими ресничек (Carson; Stephens et al., Goldstein et al.).
При 0,0019 мг/л (4 ч) выявлены изменения в легочной ткани, сопровождавшиеся образованием перекисей липидов (Thomas et al.). У кроликов ЛК50 = 0,60 мг/л (15 мин); при 0,12 мг/л — раздражение глаз (Clark, Tabershaw; Steadman et al.).
Трехчасовая ингаляция 0,028-0,048 мг/л угнетает фагоцитарную активность альвеолярных моноцитов; продукцию ими интерферона и снижает устойчивость к инфекции; 0,015 мг/л увеличивает количество внутриальвеолярных макрофагов (Valandetal., Acton, Myrvik).
У собак при 0,11-0,12 мг/л сонливость, нарушение дыхания, смерть в течение 4-5 ч; при 0,019-0,076 мг/л (6 ч) увеличение содержания метгемоглобина в крови; 0,0095 мг/л не вызывает метгемоглобинемии, но повреждает клеточные мембраны и митохондрии альвеолярных клеток и лейкоцитов (Henschler, Lfitge; Dowell et al.). После вдыхания 0,095-0,12 мг/л (2-5 ч) увеличивается смертность обезьян от инфекции, тот же эффект — при непрерывном содержании животных в течение месяца при 0,019 мг/л или 2 месяцев при 0,0095 мг/л (Henry et al.).
Человек.
Ощущение запаха и небольшого раздражения во рту и зеве наблюдалось при 0,008 мг/л, а в ряде случаев — при 0,0002 мг/л; максимальная неощутимая концентрация — 0,00011 мг/л; порог по изменению световой чувствительности глаза 0,00014 мг/л (5 мин); концентрация, не действующая на световую чувствительность глаза, 0,000087 мг/л; при вдыхании через рот порог выше — 0,00027 мг/л (Шаламберидзе). При 0,014 мг/л отмечается раздражение глаз и носа; при 0,095 мг/л раздражение через 1 мин и уменьшение диффузии CO2 в легких через 15 мин; при 0,12 мг/л раздражение и одышка (Clark, Tabershaw; Nieding et al.). Продолжительность пребывания при 0,019 мг/л ограничивается 1 ч, при 0,038 — 20 мин, при 0,051 — 10 мин; при повторении воздействия наступало привыкание (Smith). Испытуемые не чувствовали запаха и раздражения при постепенном увеличении концентрации от 0 до 0,05 мг/л в течение 54 мин (Henschler et al.). При более высоких концентрациях наблюдаются тяжелые отравления, вплоть до смертельных. Вдыхание в течение 5 мин 0,51-0,76 мг/л вызывает бронхопневмонию; 0,95 мг/л — отек легких в течение 5 мин. С воздействием чистой NO2 связывают отравления, наблюдавшиеся у сельскохозяйственных рабочих в невентилируемых силосных башиях. Ранее подобные случаи приписывали действию СО или недостатку О2.
Патологоанатомические изменения при отравлении человека, особенно в органах дыхания, — полнокровие и отек слизистых оболочек дыхательных путей, отек легких, мозаично расположенные участки эмфиземы, ателектаза, кровоизлияний, разрыв альвеол. Другие внутренние органы полнокровны, с мелкими кровоизлияниями.
При микроскопии — слущивание эпителия трахеи и бронхов, участки катарального, фибринозного и геморрагического воспаления легких, тромбы в сосудах легких, дегенеративные и некротические изменения в печени, почках, головном мозге.
У людей, работавших при 0,0008-0,005 мг/л (3-5 лет) выявлены воспалительные изменения слизистой оболочки десен, хронические бронхиты, эмфизема легких, пневмосклероз, осложненный астмоидными приступами, бронхоэктазии, тенденция к брадикардии и гипотонии; увеличение содержания гемоглобина и эритроцитов, повышение максимальной осмотической резистентности эритроцитов, гранулоцитоз, ускорение свертывания крови, снижение активности каталазы, содержания сахара и уровня альбуминов и глобулинов в крови (Vigdortschik; Косоуров; Kosmider et al.).
Симптомы хронического отравления:
Животные. При повторном воздействии 0,068 мг/л (8 ч в день, 5 дней в неделю, 6 недель) часть крыс, морских свинок, кроликов и обезьян погибает.
При 0,03 мг/л (4 ч в день, 6 раз в неделю) и 0,05 мг/л (круглосуточно в течение 2-4 недель) снижается двигательная активность крыс, увеличивается потребление кислорода; на вскрытии — катаральный бронхит, очаговый отек альвеол, эмфизема, гипертрофия и гиперплазия эпителия бронхов и бронхиолей (Саноцкий и др.; Freeman, Haydon).
При 0,017-0,026 мг/л (4 ч в день, 5 дней в неделю) через 10 дней обнаружены воспалительные изменения по всему дыхательному тракту крыс.
У морских свинок, круглосуточно содержавшихся при таких же концентрациях 4-6 недель, обнаружены увеличение активности альдолазы и молочнокислой дегидрогеназы в легких, печени, почках; увеличение анаэробных и уменьшение аэробных изоферментов в легких; значительные ультраструктурные и функциональные изменения в пиевмоцитах (Buckley, Balchum; Buckley; Juen, Sherwin). У беременных крыс вдыхавших 40-50% смесь NO2 c»8 по 10 и с 12 по 16 день беременности, снижались средняя масса и размер эмбрионов, нарушалось нормальное развитие ребер и позвоночника (Fink et al.).
Хроническое воздействие 0,0057 мг/л (2 ч в день, 5 дней в неделю) вызывает у мышей в течение 15-17 недель истощение, уменьшение содержания эритроцитов и гемоглобина, фагоцитарной активности лейкоцитов; у морских свинок к концу года — очаговое хроническое воспаление легких и метаплазия альвеолярного эпителия (Митина; Cross et al.).
Круглосуточное содержание в течение 90 дней при 0,022 мг/л сопровождается значительной смертностью крыс, морских свинок, кроликов и обезьян. При 0,0095 мг/л (6 ч ежедневно в течение года) увеличивается число случаев возникновения злокачественных новообразований в легких линейных мышей. Возможно, это связано с образованием в организме нитрозоаминов (Henschler, Ross; Wagner et al.).
Воздействие 0,005 мг/л (круглосуточно, 5 дней в неделю, 9 месяцев или по 5 ч ежедневно, 5 дней в неделю, 3 месяца) вызывает у крыс увеличение массы легких, снижение содержания в иих липидов и жирных кислот, активности холинэстеразы в плазме и эритроцитах (Kaut et al.; Arner, Rhoodes).
Круглосуточное содержание крыс в течение 2-3 лет при 0,0038 мг/л сопровождается уменьшением или исчезиовением ресиичек эпителия бронхиолей, торможением нормального отторжения эпителиальных клеток и появлением цитоплазматических кристаллоидных включений (Freeman et al.; Stephens et al.).
При 0,0024 мг/л (12 ч ежедневно, 3 месяца) нарушается эстральный цикл крыс, удлиняются сроки беременности, снижается размер плода; при 0,0009 мг/л (6-18 ч ежедневно, 3-6 месяцев) у мышей, крыс и морских свинок снижается иммуноустойчивость (Шаламберидзе; Ehrlich, Henry; Blair et al.; Kosmider et al.).
При 0,0006 мг/л (круглосуточно 3 месяца) у крыс увеличивается латентный период рефлекторных реакций; на вскрытии — катаральный бронхит, перибронхиальная пневмония и умеренный пневмосклероз; при 0.0001-0,00015 мг/л эти сдвиги отсутствуют, не обнаружено также изменений в хронаксии мышц, активности холинэстеразы, содержании SH-групп (Якимчук, Челиканов; Шаламберидзе).
Дополнительная информация:
Существует в виде равновесной смеси мономерного и димерного соединения. Жидкость при температуре кипения содержит 0,1% NO2, а пар при 100 С — 90% NO2.
В растворах органических растворителей растворяет относительно инертные металлы (напр. медь) образуя нитраты.
- «Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей» 7-е изд. т.3 Л.:Химия 1976 стр. 109-110
- «Справочник химика» т.2, Л.-М.: Химия, 1964 стр. 12-13
- Коттон Ф., Уилкинсон Дж. «Современная неорганическая химия» ч.2, М.: Мир, 1969 стр. 180-182
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 50
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
Еще по теме:
- Азота (IV) оксид — справочник по веществам
Видео:Arturo Márquez - Danzón No. 2 (Alondra de la Parra, L'Orchestre de Paris)Скачать

Окислы азота
Рис. Прибор дли демонстрации горения азота в кислороде.
Азот образует с кислородом шесть окислов: закись азота N2O, окись азота NO, двуокись азота NO2, четырехокись азота N2O4, азотистый ангидрид N2O3 и азотный ангидрид N2O5. Все они могут быть получены из азотной кислоты и ее солей.
Закись азота N2O. Закись азота получается при нагревании нитрата аммония:
NH4NO3 = N2O + 2H2O
При этой реакции один из атомов азота, входящих в состав NH4NO3, теряет электроны, а другой — приобретает их, причем оба атома азота становятся положительно одновалентными.
https://www.youtube.com/watch?v=XjZlLcBCAE0
Закись азота представляет собой бесцветный, не имеющий запаха газ, сгущающийся в жидкость при 0° под давлением 30 ат. Она довольно хорошо растворима в воде: при 0° один объем воды растворяет 1,3, а при 25° — 0,6 объема N2O. При растворении закись азота никакого соединения с водой не образует.
Закись азота — эндотермическое соединение, легко разлагающееся при нагревании на азот и кислород:
2N2O = 2N2+ O2 + 19,5 ккал
поэтому она хорошо поддерживает горение. Тлеющая лучинка, опущенная в закись азота, вспыхивает в ней, как в чистом кислороде; фосфор, сера и другие вещества также энергично сгорают в закиси азота, освобождая азот.
Закись азота для чего
Вдыхание небольших количеств закиси азота приводит к притуплению болевой чувствительности, вследствие чего этот газ иногда применяют в смеси с кислородом для наркоза при легких операциях. Большие количества закиси азота возбуждающе действуют на нервную систему; поэтому раньше ее называли «веселящим газом».
Азот оксид
Окись азота NO. При обыкновенных условиях азот и кислород не вступают в реакцию друг с другом. Но при очень высокой температуре, например при пропускании электрических искр через воздух, азот может непосредственно соединяться с кислородом, давая окись азота. Поэтому окись азота всегда образуется в атмосфере при грозовых разрядах.
Образование окиси азота при электрическом разряде может быть иллюстрировано следующим опытом. В большую колбу (рис.
) через боковые горла вставляют на пробках две толстые медные проволоки и соединяют их с полюсами большой индукционной катушки.
При пропускании через катушку тока между концами проволок образуется непрерывная искра, а над ней появляется желтоватое пламя «горящего» в кислороде азота.
Реакция образования окиси азота из азота и кислорода обратима и сопровождается поглощением большого количества тепла:
N2 + О2 ⇄ 2NO — 43,2 ккал .
При низкой температуре равновесие этой реакции практически полностью сдвинуто влево, т. е, количество образующейся окиси азота ничтожно мало. С повышением температуры равновесие начинает смещаться вправо, и о так медленно, что даже при 1000° в смеси газов содержится всего лишь около 1% окиси азота. При понижении температуры окись азота снова разлагается на азот и кислород.
Но если очень быстро охладить газовую смесь, то равновесие не успевает сразу сместиться, а потом уже не смещается вследствие крайне малой скорости реакции при низкой температуре, и таким образом, в смеси остается почти то же количество NO, которое образовалось при высокой температуре.
В лаборатории окись азота получают обычно взаимодействием разбавленной азотной кислоты с медью:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4Н2O
или в ионной форме
3Cu + 2NO3‘ + 8H• = 3Cu•• + 2NO + 4H2O
Окись азота представляет собой бесцветный газ, очень трудно сжижаемый. Жидкая окись азота кипит при —151,8° и затвердевает при —163,7°
В воде она растворима лишь незначительно один объем воды растворяет при0° всего 0,07 объема NO.
По химическим свойствам окись азота относится к числу безразличных окислов,так как не образует никакой кислоты.
Окись азота труднее других окислов азота отдает свой кислород. Поэтому в ней могут гореть лишь такие вещества, которые особенно энергичносоединяются с кислородом, как, например, фосфор. Но зажженная свеча,лучинка, сера гаснут при внесении их в окись азота.
Наиболее характерным свойством окиси азота является ее способность легко, без всякогонагревания, соединяться с кислородом с образованием бурой двуокиси азота:
2NO + О2 = 2NO2 — 27 ккал
Если, например, открыть цилиндр, наполненный окисью азота, то у отверстия его тотчас же появляется бурое облако двуокиси азота.
Двуокись азота
Бурый ядовитый газ, обладающий характерным запахом. Он легко сгущается в красноватую жидкость (темп. кип. 21,3°), которая при охлаждении постепенно светлеет и при —10° замерзает, образуя бесцветную кристаллическую массу. Наоборот, при нагревании газообразной двуокиси азота ее окраска усиливается, а при 140° становится почти черной.
Изменение окраски двуокиси азота при повышении температуры сопровождается и изменением плотности ее пара. При низкой температуре плотность пара приблизительно отвечает удвоенной формуле N2O4.
С повышением температуры плотность пара уменьшается и при 140° в точности соответствует формуле NО2—Отсюда следует, что бесцветные кристаллы, существующие при —10° и ниже, состоят, вероятно, целиком из молекул N2О4 и могут быть названы четырехокисью азота.
По мере нагревания бесцветная четырехокись азота постепенно диссоциирует с образованием молекул темнобурой двуокиси азота N02;полная диссоциация происходит при 140°. Поэтому при температурах от —10° до +140° всегда имеется смесь молекул NO2 и N2О4, находящихся в равновесии друг с другом:
N2О4 ⇄2NО2 — 13,6 ккал
Выше 140° начинается диссоциация NО2 на NO и кислород.
https://www.youtube.com/watch?v=—OJC0AdUA
Двуокись азота очень энергичный окислитель. Многие вещества могут гореть в двуокиси азота, отнимая от нее кислород. Сернистый газ окисляется ею в серный ангидрид, на чем основан нитрозный метод получения серной кислоты.
Пары двуокиси азота довольно ядовиты. Вдыхание их вызывает сильное раздражение дыхательных путей и может привести к серьезному отравлению.
При растворении в воде двуокись или, вернее, четырехокись азота вступает в реакцию с водой, образуя азотную и азотистую кислоты:
N2O4 + Н2O = HNO3 + HNО2
Но азотистая кислота очень неустойчива и быстро разлагается на азотную кислоту, окись азота и воду:
3HNO2 =HNO3 + 2NO + Н2O
Поэтому практически взаимодействие двуокиси (четырех окиси) азота с водой, особенно с теплой, идет по уравнению
3N2O4 + 2Н2O = 4HNO3 + 2NO
которое легко может быть получено сложением двух предыдущих уравнений, если предварительно первое из них умножить на 3.
В присутствии воздуха образующаяся окись азота немедленно окисляется в двуокись азота, так что в этом случае NO2 полностью переходит в азотную кислоту. Эта реакция имеет важное техническое значение и используется в современных способах получения азотной кислоты.
Если растворять двуокись (четырехокись) азота в щелочах, то образуется смесь солей азотной и азотистой кислот:
N2O4 + 2NaOH = NaNO3 + NaNO2 + H2O
Приведенные выше реакции взаимодействия четырехокиси азота с водой и щелочами показывают, что в молекуле этого вещества один атом азота имеет валентность +5,а другой — валентность +3. Поэтому четырехокись азота часто называют смешанным ангидридом азотистой и азотной кислот и изображают ее структурную формулу следующим образом:
Если мы подсчитаем общее число валентных электронов у всех атомов в молекулах NO и NO2, то найдем, что оно равно соответственно 11 (5 + 6) и 17 (5 + 2•6), т. е. выражается нечетными числами.
Окись и двуокись азота относятся к ограниченному числу молекул с нечетным числом электронов. Такие молекулы ведут себя в химическом отношении, как свободные атомы, тоже имеющие неспаренные электроны.
Молекулы с неспаренными электронами называются свободными радикалами.
Азотистый ангидрид N2O3
Представляет собой темно-синюю жидкость, кипящую при +4° и разлагающуюся при этом на окись и двуокись азота. Смесь равных объемов окиси и двуокиси азота при охлаждении вновь образует азотистый ангидрид:
N2O3 ⇄ NO + NO2
Азотистому ангидриду соответствует азотистая кислота.
Азотный ангидрид N2O5 — твердое кристаллическое вещество, плавящееся при 30°. Он может быть получен действием фосфорного ангидрида на азотную кислоту:
2HNO3 + Р205 = N2O5 + 2НРО3
Азотный ангидрид является очень сильным окислителем. Многие органические вещества при соприкосновении с ним воспламеняются. В воде азотный ангидрид легко растворяется с образованием азотной кислоты.
139 140 141
Вы читаете, статья на тему Окислы азота
Видео:Johannes Brahms - String Quartet No 2 in A minor, Op.51 No 2 - Jerusalem QuartetСкачать

Оксиды азота
При описании свойств азота отмечалось, что при непосредственном взаимодействии азота с кислородом образуется только оксид азота (II) NO. Однако существуют оксиды азота со всеми возможными степенями окисления (от +1 до +5).
При обычной температуре N2O — бесцветный газ со слабым приятным запахом и сладковатым вкусом; обладает наркотическим действием, вызывая сначала судорожный смех, затем — потерю сознания.
Способы получения
1. Разложение нитрата аммония при небольшом нагревании:
NH4NO3 = N2O↑ + 2Н2О
2. Действие HNO3 на активные металлы
10HNO3(конц.) + 4Са = N2O↑ + 4Ca(NO3)2 + 5Н2О
NO — оксид азота (II), монооксид азота
При обычной температуре NO — бесцветный газ без запаха, малорастворимый в воде, очень токсичный (в больших концентрациях изменяет структуру гемоглобина).
I. NO — окислитель
2NO + SO2 + Н2О = N2O↑ + H2SO4
2NO + 2H2 = N2 + 2Н2О (со взрывом)
II. NO — восстановитель
2NO + O2 = 2NO2
10NO + 6KMnO4 + 9H2SO4 = 10HNO3 + 3K2SO4 + 6MnSO4 + 4Н2О
NO2 — оксид азота (IV), диоксид азота
При обычной температуре NO2 — красно-бурый ядовитый газ с резким запахом. Представляет собой смесь NO2 и его димера N2O4 в соотношении -1:4. Диоксид азота хорошо растворяется в воде.
NO2 — кислотный оксид, смешанный ангидрид 2-х кислот
NO2 взаимодействует с водой, основными оксидами и щелочами. Но реакции протекают не так, как с обычными оксидами — они всегда окислительно — восстановительные. Объясняется это тем, что не существует кислоты со С.О. (N) = +4, поэтому NO2 при растворении в воде диспропорционирует с образованием 2-х кислот — азотной и азотистой:
2NO2 + Н2О = HNO3 + HNO2
Если растворение происходит в присутствии O2, то образуется одна кислота — азотная:
4NO2 + 2Н2О + O2 = 4HNO3
Аналогичным образом происходит взаимодействие NO2 со щелочами:
в отсутствие O2: 2NO2 + 2NaOH = NaNO3 + NaNO2 + Н2О
в присутствии O2: 4NO2 + 4NaOH + O2 = 4NaNO3 + 2Н2О
NO2 — очень сильный окислитель
По окислительной способности NO2 превосходит азотную кислоту. В его атмосфере горят С, S, Р, металлы и некоторые органические вещества. При этом NO2 восстанавливается до свободного азота:
10NO2 + 8P = 5N2 + 4P2O5
2NO2 + 8HI = N2 + 4I2 + 4Н2О (возникает фиолетовое пламя)
В присутствии Pt или Ni диоксид азота восстанавливается водородом до аммиака:
2NO2 + 7Н2 = 2NH3 + 4Н2О
Как окислитель NO2 используется в ракетных топливах. При его взаимодействии с гидразином и его производными выделяется большое количество энергии:
2NO2 + 2N2H4 = 3N2 + 4Н2О + Q
N2O3 и N2O5 — неустойчивые вещества
Оба оксида имеют ярко выраженный кислотный характер, являются соответственно ангидридами азотистой и азотной кислот.
N2O3 как индивидуальное вещество существует только в твердом состоянии ниже Т пл. (-100С).
С повышением температуры разлагается: N2O3 → NO + NO2
N2O5 при комнатной температуре и особенно на свету разлагается так энергично, что иногда самопроизвольно взрывается:
2N2O5 = 4NO2 + O2
📽️ Видео
HAUSER - Waltz No. 2 (Shostakovich)Скачать

Rachmaninoff - Symphony No 2 in E minor, Op 27 - PappanoСкачать

Шостакович - Вальс №2 (Shostakovich - Waltz No. 2)Скачать

Waltz No.2 - Dmitri Shostakovich | Andre Rieu | Second Waltz | Wedding Dance ChoreographyСкачать

Shostakovich / F. Noack : Waltz No.2 | F. Noack, pianoСкачать

Borodin: Quartet No. 2 in D major for Strings, III. Notturno: AndanteСкачать

Ludwig van BEETHOVEN, Piano Concerto No. 2, Op. 19, Alexandra Dovgan, Stockholm 12.05.2021Скачать

САМЫЙ УМНЫЙ И ТУПОЙ ЧИТЕР В АМОНГ АС #2Скачать

№2 УРОКИ ИВРИТА С АНЕЧКОЙ ║ ИВРИТ ДЛЯ НАЧИНАЮЩИХ ║ УЧИМ ИВРИТ С НУЛЯ ║ ИВРИТ АЛФАВИТ ║ БУКВЫ ИВРИТАСкачать

Dmitri Shostakovich - Waltz No. 2 (from Suite for Variety Orchestra) | Piano with SheetСкачать

Rachmaninoff: Piano Sonata No.2, Op.36 (Lugansky, Kocsis)Скачать

Franz Liszt - Piano Concerto No. 2, S.125 {René Duchâble}Скачать

Rachmaninoff: Piano Concerto no.2 op.18 - Anna Fedorova - Complete Live Concert - HDСкачать

Valentina Lisitsa plays Liszt's Hungarian Rhapsody No. 2Скачать